病床的SUNGO的欧盟授权代表
更新时间:2024-05-18 浏览数:67
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
sungo可以办理美国FDA注册,FDA510K
近两年,欧盟加强了评价和上市后监督的要求。2016年7月,器械评估的全新文件MEDDEV 2.7/1第4版在欧盟会网站上正式发布。该指南明确了现有的一些要求,对于制造商如何进行一个健全、系统的评价,以及如何数据和结论的科学有效性有了更明确的。这也给制造商带来了新的挑战。

我们的服务包括: 确定您的器械在加拿大的具体分类。 代表您准备加拿大器械许可证(MDL)或加拿大器械机构许可证(MDEL)申请。 制定、实施或修改您的ISO 13485质量管理体系以满足加拿大的相关规定。 提供关于ISO 13485与加拿大器械法规(CMDR)方面的现场员工培训。 确定每年应向加拿大缴纳的许可证费用。 可以现场审计服务,确保符合ISO 13485:2003以及CMDR相关规定。 了解加拿大器械注册服务的更多信息,请联系我们

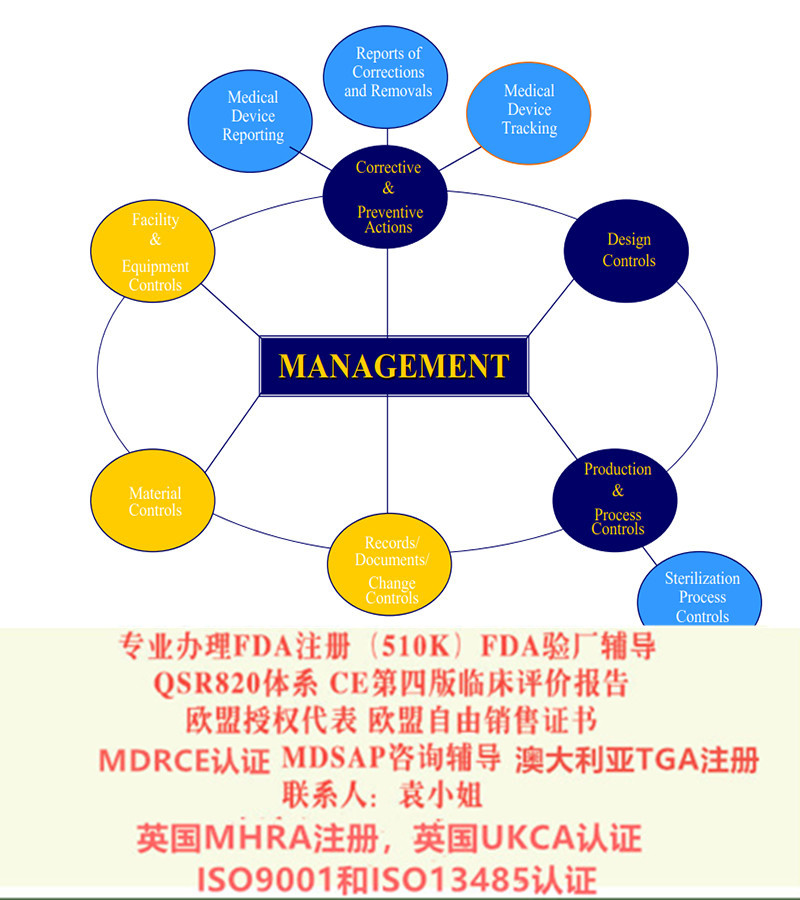
说到这里 企业应该如何面对新法规的升级呢?按照MDR法规要求。关键的内容包括如下几个方面: 企业的质量管理体系 EN ISO13485:2016 ,产品的型式试验 TYPE TESTING , 产品的技术文件 TECHNICAL CONSTRUCTION FILES要满足这些要求,通常需要咨询机构和咨询师的协助。本公司拥有一支经验丰富的咨询师队伍可以为贵司提供这些服务,包括: 协助贵司建立/升级器械质量管理体系,将MDR法规的内容整合进去 协助贵司确定产品的欧盟协调标准,确认检测实验室的,样品准备以及检测不合格整改的研讨 按照MDR要求协助贵司准备技术文件,包括风险分析报告,评估资料,基本要求检查表等 协助贵司按照欧盟的要求修订说明书和标签,使其满足出口的要求。

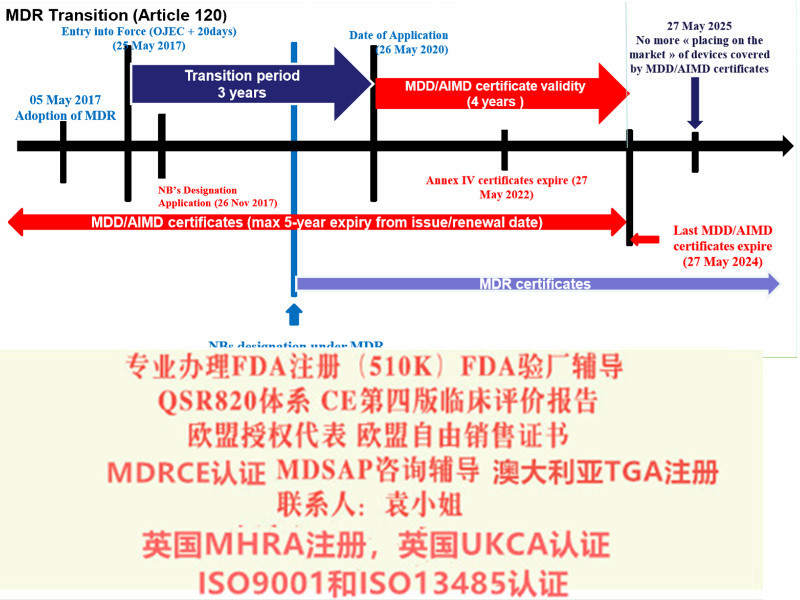
IVDR IVD产品如果想进入欧盟市场,需要CE认证 欧盟会(EC)的DG SANTE部门(健康和食品总局)负责这件事情 但各成员国的具体的落实需要靠CA(器械部门),由NB(备案机构)按照欧盟指令和法规要求执行器械产品的符合性评估和认证 执行的标准开始是按照90年代出的器械法规中的IVDD来IVD,但是由于这个标准太松,2017年正式上了新法规IVDR,2022年取代IVDD 原来按照IVDD标准批的证书2024年将过期 也是现在还处于过渡期 新的法规更加关注:产品、性能评估、评价、上市后 产品分类也有了变化:class ABCD classA的要求可能,产家自我声明即可 class BCD都需要NB 通过了CE认证的产品可以在36个流通,一些东南亚也认可
非级医用防护服、隔离衣、手术衣在MDR中属于普通I类产品 欧盟授权代表;
http://sungofda.cn.b2b168.com