产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
法规条款增加,认证评审更加严格,企业的相关信息都会被收集到欧洲器械数据库(EUDAMED);
SUNGO提醒我们的客户在申请产品CE认证时,在过渡阶段请谨慎考虑是选用法规还是采用老的指令方案,同时也需要对NB机构的发证进行了解和确认以保证产品在欧盟市场销售的可延续性。

产品注册
制造商在器械投放市场前,应在Eudamed进行注册,提交企业信息及器械信息,包括器械的UDI信息,取得单一注册号(SRN)。
综上所述,持有MDD CE证书的制造商需确认是否有满足过渡条款内提到相关要求,在近一次监督审核前,尽快建立完善相应文件,以保证产品在欧盟市场上的顺畅流通。

新的器械法规(2017/745 / EU)(MDR)和体外诊断器械法规(2017/746 / EU)(IVDR)使欧盟立法与技术进步,科学变革和进步在法律制定上保持一致。新法规将建立一个健全,透明,可持续的框架,得到国际认可,可提高性并为制造商创造公平的市场准入。与指令不同,法规不需要转变为法。器械法规(MDR)的背景MDR将取代现有的器械指令(93/42/EEC)(MDD)和主动植入式器械指令(90/385/EEC) (AIMDD)。
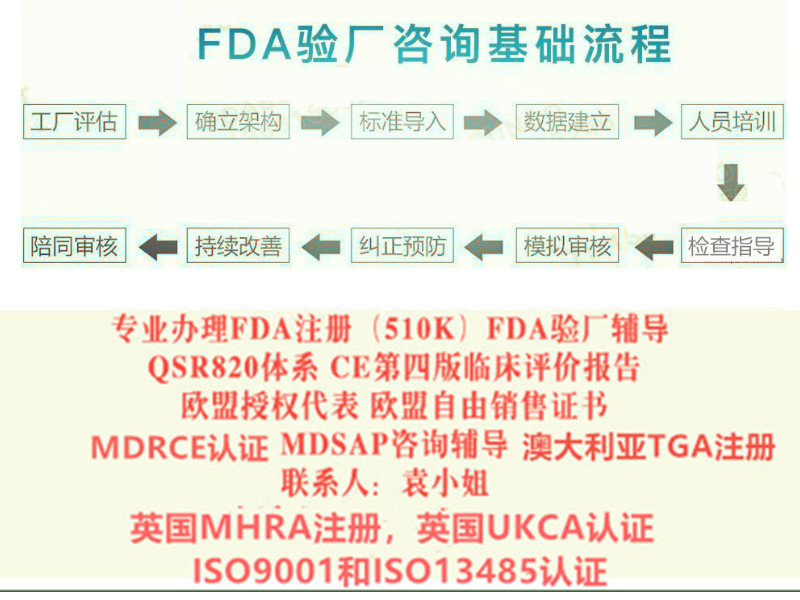
我们的咨询业务
1:MDR法规培训
新法规立法过程、变化及转换期
MDR覆盖的范围,包括和MDD, AIMD的修订要点及主要区别
MDR法规结构及条款清单
MDR分类规则要求
MDR对经销相关方 (Economic Operators)要求
MDR符合性审核程序
质量管理体系的全新要求,以及MDR与ISO 13485:2016的关系
通用和性能要求GSPR
MDR对技术文档TCF的要求
评价CER上市后追踪PMCF的要求
上市后监督PMS的要求
MDR中对器械性标识UDI要求;
欧盟符合性声明 (EU declaration of conformity) 要求
器械欧盟数据库(European Database on Medical Devices, EUDAMED)介绍及输入
公告机构的审核准则
充分准备以应对MDR欧盟器械法规相关的审核
Q&A
2:专项,MDR法规变化-UDI和标签
MDR法规变化-GSPR
MDR法规变化-PMS、PMCF系统
MDR法规变化-质量管理体系
MDR法规变化-技术文件
MDR法规变化-评估,调查
MDR法规变化-风险管理
可用性评价
3.欧代和注册服务SUNGO 荷兰和德国公司可以提供欧盟授权代表服务,同时提供向当地部门申报注册的服务。
4.整体MDR升级换版实施服务 包含上述1、2、3的全部内容,还包括针对公告机构审核开具的不符合的整改服务。
我们的服务流程
1 预评估:简要管理,以确保清楚了解MDR的重要性和业务影响
预评估考虑组织的挑战:管理意识,人员配备能力和可用性,预算影响
2.差异分析 评估对产品、内部资源、组织和预算的影响
检查新的分类规则(MDR I, IIa,IIb,III类),确认现有和产品的符合性评估路线
核对器械定义,确认是否属于扩大范围或属于附录16中所涉及的属于器械的范围
检查产品与关NB机构有关的要求
审查现有技术文档(技术文件)的变更
评估及更新质量管理体系(以下第3点)
检查可用证据和风险管理的充分性,识别差异(第56条)
评估产品标签(附件I第Il1章)
确保上市后监督的安排充分适宜够(第七章第1节)
制定上市后性能跟踪(PMCF,附件XIV B部分)
做好迎接新的警戒需求的规定(第七章第二节)
确保可追溯相关方面的义务(第3章)
3,质量体系评估 评估新IVDR法规下QMS符合标准和流程的程度
增加新法规应用于QMS的要求
协助和识别合规负责人(PPRC)并参与培训
4,公告机构NB确认 选择合适的公告机构,确认公告机构资质及范围
建立新法规实施过渡计划
5,技术文件编制 编制符合MDR要求的技术文件(TD)
编制评估报告、生物学评价报告和风险管理等技术文件等
产品设计开发流程,确保输入及输出的完整性
确认标签、上市后监督、上市后性能跟踪方案
技术文件整改(风险管理报告,性能评估报告,GSPR等)
6,QMS建立:更新现有体系中IVDR用于QMS的要求
定制企业合规QMS系统
执行体系实施计划确保覆盖各个方面及各方面责任
7, 可追溯性UDI 建立可追溯性QMS要求
建立UDI系统程序及制度
确认UDI的规划及实施
我公司办理:ISO13485认证,CE评估报告编写 等产品出口的相关认证
http://sungofda.cn.b2b168.com









