隔离衣的MHRA认证供应
发货地址:上海市金山区
产品数量:123456.00个
价格:面议
规格1
密度4
宽度2
质量5
高度3
如果有的话,英国负责人的姓名和地址必须包含在已有UKCA商标的产品标签上。具有CE标志的设备的标签上不必包括英国负责人的详细信息。
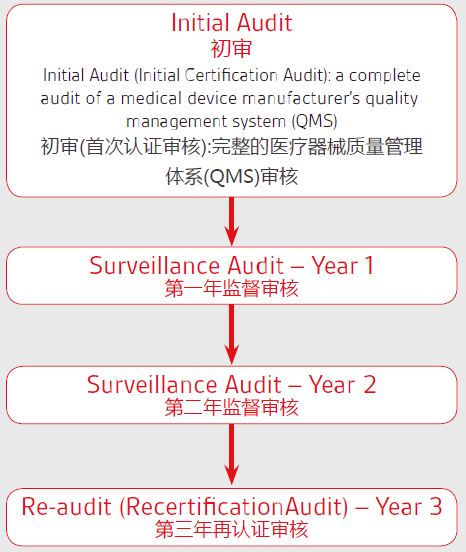
我公司办理产品出口欧盟、美国、中东南美等的各种认证: TUV莱茵,TUV南德等CE认证(MDD/MDR法规),CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。 Q:MDR涵盖哪些产品? A:MDR包含了MDD及AIMDD涵盖的所有产品。新法规扩大了应用范围,覆盖一些非用途的产品,如美瞳、面部填充或、、皮肤改善和美容等产品。具体可参阅MDR中的Annex XVI。 Q:产品分类是否有变化? A:MDR对于产品的分类规则有一些变化,应用范围比MDD和AIMDD的范围更广。具体可参阅MDR中的Annex VIII。 Q:IIb类植入式器械的符合性评估程序是否有变化? A:IIb类植入式器械需要有特定产品证书(product specific certificates)——具体内容可参见器械法规MDR Annex IX或Annex X 。此证书上需要显示产品的UDI。此类产品在欧盟上市前,如证书信息有变更,必须通过公告机构的审核。 Q:IIb类植入式器械的技术文档评估可以按照通用产品组中抽样原则进行嘛? A:MDR指出IIb类植入式器械需要通过详细的技术文档审核,类似于MDD中III类产品的技术文件要求。因此抽样的方案是不可行的。 1Q:III类产品的5年换证审核是由欧盟会审核,还是由发证的公告机构审核? A:如果产品没有实质性的变化,5年的换证审核不需要由欧盟会审核。如产品有重大变更,则需要欧盟会的介入。 Q:MDR涵盖的产品是否可以申请自我声明? A:MDR中对于I类(非测量、非、非重复使用的产品)可以使用自我声明。 Q:对于I类可重复使用的产品,需要提供什么样的文件以产品的清洁? A:除了产品的清洁说明书和相关确认文件,公告机构的审核还包括其他方面,如、、保养和功能测试。更多信息,可参见MDRArticle 52 。 Q:对照器械(equivalent device)是否需要进行ISO 10993测试? A:有可能。从生物学角度来看,这取决于此器械和对照器械实质等同的程度。此外还需注意的是,MDR有与器械生物性相关的、立的和性能要求,此要求也可能需要器械按照ISO 10993进行测试。 Q:定期性更新报告(PSUR)是否会纳入评价报告(CER)? A:MDR要求评价需要根据上市后监督(PMS)的数据定期更新。但是,将定期性更新报告(PSUR)纳入评价报告(CER)并非强制。应使用定期性更新报告(PSUR)所基于的上市后监督(PMS)数据来更新评价报告(CER)。 Q:MDR对药械组合产品的要求是否有变化? A:理论上来说,除了产品本身需要额外的审查程序,MDR对药械组合产品的符合性评审要求没有变化。MDR中关于UDI、PMS、评价等附加要求也适用于这些产品。然而,“行为责任”(liable to act)一词已经从Rule 14中,因此可能会有更多的产品需要药品咨询。 Q:MDR对动物源性器械的影响以及法规的要求? A:Rule 18的描述中增加了使用人源细胞或组织的器械。然而,除了包括UDI、PMS、评价等附加要求外,评价使用动物源组织的产品的方式不会有变化。 Q:对于立产品包装以及多个产品的包装, UDI是否都适用? A:如果是立包装的产品,在每个产品的包装上都需要有UDI。对于多个产品的包装,(例如,一盒手套),只要求外包装显示UDI。具体请参阅法规Article 27和 Annex VI。 Q:新的UDI要求是否与现行的美国FDA的UDI要求一致? A:MDR与美国FDA对于UDI的要求是存在一定差异的。但是也有许多相似点。具体可参见法规Annex VI关于UDI的要求。
我司作为欧盟授权代表,被英国MHRA批准可以代表企业完成注册证。注册企业信息可在MHRA查询

现在做出口认证的时候为什么会提到,甚至强调欧代?美代? FDA注册时,都知道必须授权一个美国代理人,简称美代,可以是美国境内的普通人,也可以是一个企业,但是近年客户对于美代的要求越来越严格,美国境内的普通人远远无法解决企业遇到的问题,而且是经常的联系不上,美代没找好,没遇到问题还好,遇到问题了联系不上,严重的可能会让企业被开出警告信,产品出口受阻,选择一个好的美代很有必要。 欧盟授权代表,在CE认证时很多客户会选择的一项服务,虽然对于那些产品在欧盟法规上属于一类的产品法规规定是不需要加贴欧代信息的,但是现在欧盟对于I以上的 产品是必须加印欧代信息,而很多一类的产品客户也会选择欧代,同等于美代,欧代的重要性也显而易见。 欧代、美代主要是做什么的呢? 欧代、美代是企业与国外客户联系的纽带,国内外时间差异,产品一旦遇到问题,联系国内需要时间,这个时候可以联系美代,欧代了,当国外客户不能及时联系国内时,欧代、美代可以帮忙传达,所以,在认证时一定要选择比较有资质,比较好的企业作为自己的欧代。美代,避免关键时间联系不上 SUNGO可以在过渡期内为提供新旧法规的咨询服务,包括: 协助判定产品分类 协助选择合理的符合性途径 协助选择合适的认证机构 制定认证的解决方案 协助完成评估 编写CE技术文件 欧盟代表服务

英国MHRA注册完成后可以申请MHRA颁发的自由销售证书,沙特,阿根廷等中东南户进口需要
SUNGO服务的宗旨不仅是完成项目,而是帮助客户解决问题并达成目标。所有客户均有专属服务人员,针对市场准入过程中的问题提供的支持和解答。选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。
http://sungofda.cn.b2b168.com









