产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
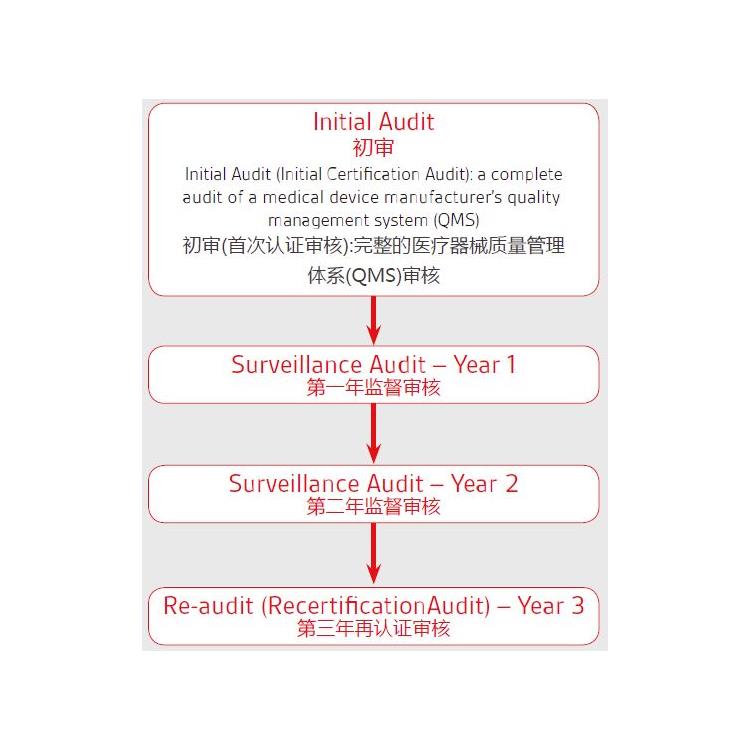
个人防护类防护服属于Ⅲ类产品,需要公告机构介入,应遵循以下流程才能满足出口欧盟的准入条件:
① 企业需将产品送到公告机构实验室进行型式检测;
② 编制产品技术文件;
③ 结合PPE法规建立体系;
④ 完成公告机构现场审核,即可获得证书。
SUNGO有丰富的欧盟注册经验。SUNGO实验室可以开展隔离衣、手术衣的性能测试和验证服务,助力客户产品顺利上市欧盟市场保驾**。
我们的咨询业务
1:MDR法规培训
新法规立法过程、变化及转换期
MDR覆盖的范围,包括和MDD, AIMD的修订要点及主要区别
MDR法规结构及条款清单
MDR分类规则要求
MDR对经销相关方 (Economic Operators)要求
MDR符合性审核程序
质量管理体系的全新要求,以及MDR与ISO 13485:2016的关系
通用和性能要求GSPR
MDR对技术文档TCF的要求
评价CER上市后追踪PMCF的要求
上市后监督PMS的要求
MDR中对器械性标识UDI要求;
欧盟符合性声明 (EU declaration of conformity) 要求
器械欧盟数据库(European Database on Medical Devices, EUDAMED)介绍及输入
公告机构的审核准则
充分准备以应对MDR欧盟器械法规相关的审核
Q&A
2:专项,MDR法规变化-UDI和标签
MDR法规变化-GSPR
MDR法规变化-PMS、PMCF系统
MDR法规变化-质量管理体系
MDR法规变化-技术文件
MDR法规变化-评估,调查
MDR法规变化-风险管理
可用性评价
3.欧代和注册服务SUNGO 荷兰和德国公司可以提供欧盟授权代表服务,同时提供向当地部门申报注册的服务。
4.整体MDR升级换版实施服务 包含上述1、2、3的全部内容,还包括针对公告机构审核开具的不符合的整改服务。
我们的服务流程
1 预评估:简要管理,以确保清楚了解MDR的重要性和业务影响
预评估考虑组织的挑战:管理意识,人员配备能力和可用性,预算影响
2.差异分析 评估对产品、内部资源、组织和预算的影响
检查新的分类规则(MDR I, IIa,IIb,III类),确认现有和产品的符合性评估路线
核对器械定义,确认是否属于扩大范围或属于附录16中所涉及的属于器械的范围
检查产品与关NB机构有关的要求
审查现有技术文档(技术文件)的变更
评估及更新质量管理体系(以下第3点)
检查可用证据和风险管理的充分性,识别差异(第56条)
评估产品标签(附件I第Il1章)
确保上市后监督的安排充分适宜够(第七章第1节)
制定上市后性能跟踪(PMCF,附件XIV B部分)
做好迎接新的警戒需求的规定(第七章第二节)
确保可追溯相关方面的义务(第3章)
3,质量体系评估 评估新IVDR法规下QMS符合标准和流程的程度
增加新法规应用于QMS的要求
协助和识别合规负责人(PPRC)并参与培训
4,公告机构NB确认 选择合适的公告机构,确认公告机构资质及范围
建立新法规实施过渡计划
5,技术文件编制 编制符合MDR要求的技术文件(TD)
编制评估报告、生物学评价报告和风险管理等技术文件等
产品设计开发流程,确保输入及输出的完整性
确认标签、上市后监督、上市后性能跟踪方案
技术文件整改(风险管理报告,性能评估报告,GSPR等)
6,QMS建立:更新现有体系中IVDR用于QMS的要求
定制企业合规QMS系统
执行体系实施计划确保覆盖各个方面及各方面责任
7, 可追溯性UDI 建立可追溯性QMS要求
建立UDI系统程序及制度
确认UDI的规划及实施
英国的法规是:英国法律(UK MDR 2002)(相当于欧盟的MDD/IVDD指令)
需要办理以下认证可以随时找我 :
1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书
2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书
3:出口美国:美国FDA注册,FDA510K,QSR820体系
4:中国:国内的器械注册证和生产许可证
5:出口加拿大:加拿大的MDEL注册
6:质量管理体系认证:ISO13485咨询和认证

对于需要公告机构介入的器械,符合性声明的签署通常是符合性评定程序的一步。在未取得公告机构签发的CE证书之前,制造商无法签署正式的DOC文件。不过制造商可以先起草一份DOC的草案提供给公告机构审查。而对于*公告机构介入的器械,制造商在法规所要求的产品符合基本要求的证据准备充分后,即可签署DOC。
DOC作为法规要求的重要文件,制造商应该按照质量管理体系中文件控制程序的要求进行管控。DOC中任何内容发生了变更,则需重新签发。特别需要注意的是,对于由公告机构发证的产品,DOC中任何内容的变更,都需得到原发证公告机构的评审和批准。

类似于质量授权人注意到新法规主要在以下几点上发生了变化:1.器械的定义;2.器械的分类;3.基本和性能要求;4.技术文件要求;5.评价;6.上市后;7.Eudamed数据库;8.对NB公告机构的要求(新法规生效后NB将按照新的要求重新进行授权);9.对高风险器械的新增了要求;总的说来新的MDR和IVDR加强了体系管理,对高风险设备增加了相关规定比如对于非用途但具有与器械相似特性的设备也将受到新法规的管辖(如用于美容的彩色眼镜),提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、设备将有一个的识别号这加强其在整个供应链的可追溯性。
选择SUNGO,不是选择了一次性的合作伙伴 因为,所以放心!
http://sungofda.cn.b2b168.com