产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
级医用防护服、隔离衣、手术衣,欧盟授权代表,签署《欧代协议》;
ISO 17664的规定适用于用于侵入性或其他直接或间接接触患者的设备。ISO 17664中没有定义处理指令,相反,ISO 17664规定了一些要求,以协助器械制造商提供详细的加工说明,包括下列活动(如适用):
a) 使用时的初始处理;
b) 清洗前准备;
c) 清洁;
d) ;
e) 干燥;
f) 检查和维修;
g) 包装;
h)
i) 存储
j) 运输
需要办理以下认可以随时找我 :
1:出口欧盟:MDR CE认/IVDRCE认,欧盟授权代表,欧盟注册,欧盟自由销售书
2:出口英国:英国代表,英国MHRA注册,UKCA认,英国自由销售书
3:出口美国:美国FDA注册,FDA510K,QSR820体系
4:中国:国内的器械注册和生产许可
5:出口加拿大:加拿大的MDEL注册
6:质量管理体系认:ISO13485咨询和认

MDRCE认,CEMDR认,编写CE技术文件,CE第四版评价报告,(MDRCE技术文件:Medical Device Regulation 2017/745/EU)
我公司是做:
新MDR法规和MDD指令的欧盟CE认,CE第四版评价报告更新/编写
欧盟自由销售书,欧盟授权代表(德国,荷兰,英国),
ISO9001/ISO13485认以及咨询
FDA注册,FDA510K,FDA验厂/陪审和翻译
MDSAP咨询,国内注册,生产许可的办理

针对III类和可植入器械,提出了评估报告更新的频率;明确实质等同性需考虑的特点;要求其与风险管理的相互作用等等。申请MDR 技术文件需要资料 1.公司信息 2.产品信息 3.工艺流程 4. 5.其它技术文件申请MDR 技术文件周期: 正常4周左右,如有节假日顺延,如有紧急,可申请MDR法规
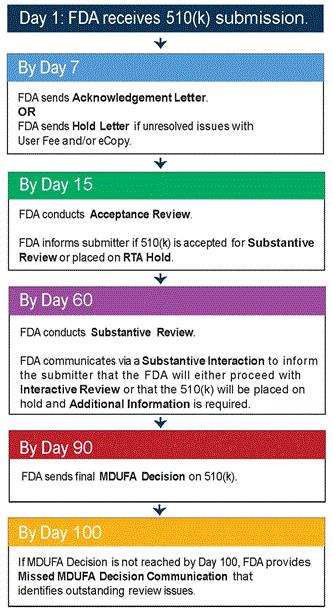
IIa类器械制造商应在必要时至少每两年更新PSUR ,IIb和III类器械的制造商应至少每年更新PSUR。
警戒 (MDR第87~92条)
制造商的严重事故和现场纠正措施需向相关主管当局进行报告,并根据事件的严重性规定了报告期限,具体期限如下表。同时,报告事件需要上传到MDR规定的电子系统--EUDAMED。
SUNGO服务的宗旨不仅是完成项目,而是帮助客户解决问题并达成目标。所有客户均有专属服务人员,针对市场准入过程中的问题提供的支持和解答。选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。
http://sungofda.cn.b2b168.com









