编写全套的MDRCE技术文件的周期和流程-需要什么材料
更新时间:2025-06-17 浏览数:1380
所属行业:
咨询 管理咨询
发货地址:上海市金山区石化街道
产品规格:2
产品数量:2345.00个
包装说明:3
价格:面议
产品规格2包装说明3咨询范围2
咨询类型4
服务项目3
品牌4
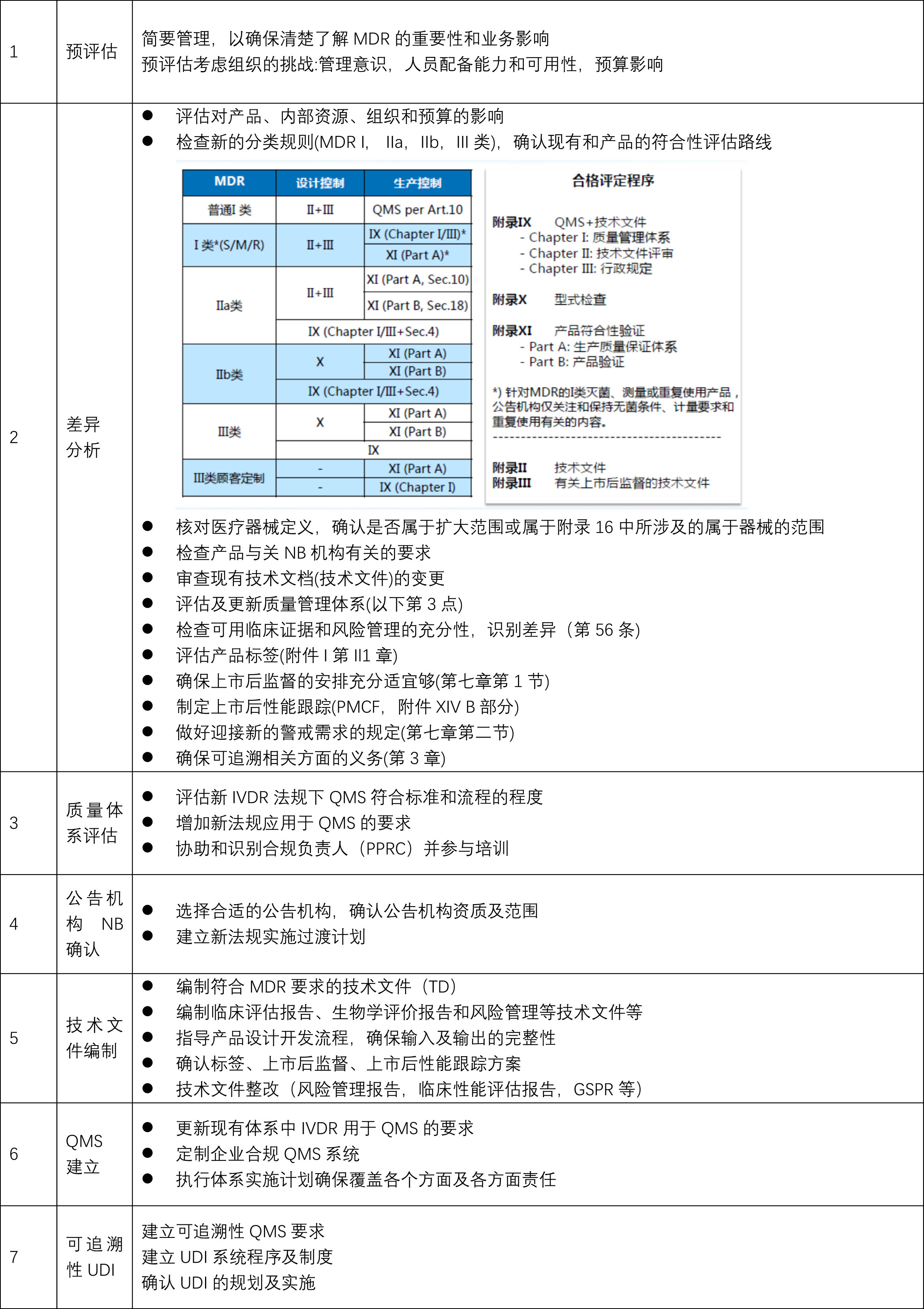
CE技术文件2017年2月Regulation (EU) 2017/745 on Medical Devices医疗器械法规(MDR)提案发布,同年3月,欧盟成员国一致表决同意MDR。2017年5月5日,欧盟Official Journal正式对外宣MDR法规内容。MDR新法规将取代现行的有源医疗器械指令Council Directive 90/385/EEC on Active Implantable Medical Devices (AIMDD) (1990)以及医疗器械Council Directive 93/42/EEC on Medical Devices (MDD) (1993)指令。原计划2020年5月26日正式实施的MDR受**新冠影响将推迟实施时间至2021年5月26日。在此期间,仍然可以进行以下MDD书的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户书更新的相关活动;现有MDD客户书更新的申请(包括提前更新的申请);现有MDD客户重大变更的申请期。虽然MDR的正式实施有延期,但是有例外情况如:· MDD产品的投放截止日期仍为2024年5月26日· MDD产品供应截止日期仍为2025年5月26日。对制造商和产品的影响而言,93/42 EEC指令和MDR基本上具有相同的基本监管要求。没有删除现有的需求,但是MDR添加了新的需求,与目前93/42指令相比,MDR更加强调生命周期方法的*性,并有临床数据支持。MDR对公告机构的*提出了更严格的要求,对国家主管当局和**加强了控制和监测。MDR对某些设备重新分类,范围更广。例如,MDR明确涵盖用于清洁、消毒或消毒其他医疗设备的所有装置(第2.1条);一次性医疗器械(第17条)};和某些无医疗用途的装置(附件十六)。MDR还包括在互联网上销售医疗器械以及用于远程提供诊断或**服务的医疗器械(第6条)。MDR为一些Ilb类器械和植入性Il类器械引入了由独立*小组进行的临床评估咨询程序(第54条)。新的标识识别系统(UDI系统)(第27条)将有力地增强市场后*相关活动的可追溯性和有效性。MDR还将提高透明度,公开有关设备和研究的信息。新的欧洲医疗设备数据库eudamed将在提供数据和增加数据的数量和质量方面发挥核心作用(第33条)2021年MDR法规的实施日期逐渐临近,如何在过渡期截至前取得MDD的书,如何或快速取得MDR书。上海沙格有着的咨询师团队,丰富的案例经验。http://sungofda.cn.b2b168.com