周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
十多年里,SUNGO已为**30多家上市公司和**器械制造商,合计5000多家企业提供过相关服务。
Class I:
1. 为申请Medical Device Establishment License (MDEL)准备相应的技术文件
2. 提交MDEL申请,支付行政收费。
3. 申请评审通过,将在Health Canada网站公示。
Class II:
1. 通过CMDCAS认可的认机构进行ISO 13485 审核认(体系审核除ISO13485要求外还要包括CMDR的要求),获得。
2. 准备Canadian Medical Device License (MDL)申请。
3. 提交MDL申请,并交纳行政收费。
4. Health Canada评审MDL申请, 评审通过后进行网站公示。

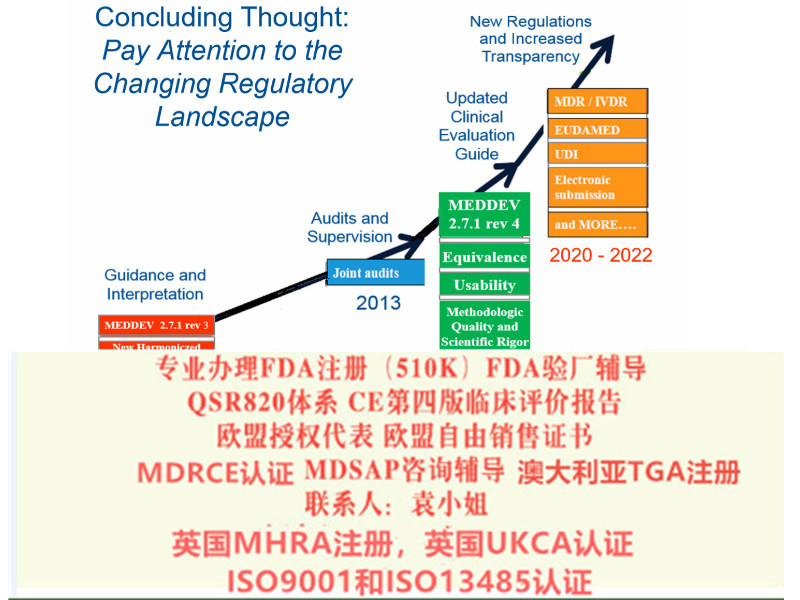
新的标识识别系统(UDI系统)(第27条)将有力地增强市场后*相关活动的可追溯性和有效性。
MDR还将提高透明度,公开有关设备和研究的信息。新的欧洲设备数据库eudamed将在提供数据和增加数据的数量和质量方面发挥核心作用(第33条)
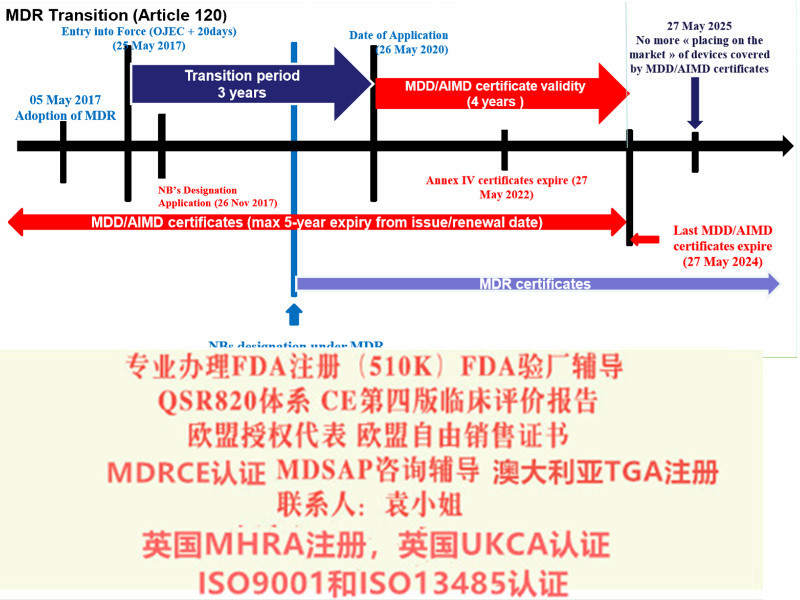
2021年MDR法规的实施日期逐渐临近,如何在过渡期截至前取得MDD的,如何或快速取得MDR。上海沙格有着的咨询师团队,丰富的案例经验。

SUNGO SUNGO Europe B.V. 可以办理。
SUNGO可以在过渡期内为提供新旧法规的咨询服务,包括:
协助判定产品分类
协助选择合理的符合性途径
协助选择合适的认机构
制定认的解决方案
协助完成评估
编写CE技术文件
欧盟代表服务
加拿大的管理实行产品注册制度。
不同于美国食品管理局(FDA)彻底管制,由对产品注册管理,再由的现场审(GMP审查),亦不同于欧洲的完全第三方公告机构(Notified Body)检查制度(CE 认),加拿大实行注册结合第三方的质量体系审查。这里所说的第三方,指经加拿大标准会(SCC) 所认可的能够进行加拿大器械合格评定体系(CMDCAS, Canadian Medical Devices Conformity) 审核的第三方机构。
CMDCAS注册及分类
依据Canadian Medical Devices Regulations (CMDR) SOR/98-282 as published by Health Canada.根据器械的使用风险将器械分为I, II,III,IV四个分类,如I类器械为风险,IV类器械风险为。为此针对制造者提出的产品注册要求也是逐级增加,要求制造者实行的体系是愈加详尽。
注册的基本流程介绍如下:
SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。十多年里,SUNGO已为**30多家上市公司和**器械制造商,合计5000多家企业提供过相关服务。
SUNGO始终追求支持、服务和客户满意。
http://sungofda.cn.b2b168.com