新乡拐杖的MDRCE认
更新时间:2025-04-26 浏览数:51
所属行业:
商务服务 认服务
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
非级医用防护服、隔离衣、手术衣在MDR中属于普通I类产品 完成欧盟主管当局注册,注册通常需要4-6周。
哪些情况下需要提交FDA510(k)
将一种器械引入美国市场
改变已经入市的器械的使用目的
对已经入市的器械进行改变或更新(这种变更或更新会影响器械的或有效性,这种改变或更新包括设计、材料、化学成分、驱动力、生产流程或者预期用途)

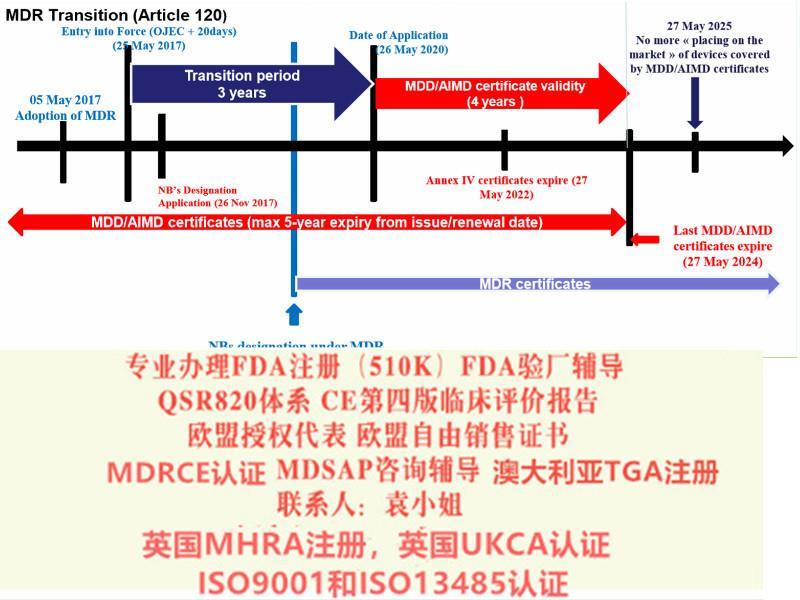
关于法规过渡期MDR 过渡期为3 年,共涉及四个时间点(见表1):欧盟器械新法规MDR主要变化情况介绍仅具有根据90/385/EEC 和93/42/EEC 指令签发的书的器械可投放市场的前提是自MDR 适用之日起,其在设计和预期目的上无显著变化并符合新法规有关市场后监察、市场监察、警戒、经济运营商及器械注册的规定。通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。

对于特定Ⅲ类器械和Ⅱ b 类器械产品,在已委派必要的器械协调小组(MDCG)、小组前提下,同样可通过指令豁免在2020 年5 月26 日之前投放市场。
法规关于公告机构的要求(正文第35~50 条) 自2017 年11 月26日起适用,即公告机构在新法规发布后的六个月内即应开始进行相应的申请,符合要求后方可依据新法规开展符合性评估。
同时法规对成员国主管机构的和MDCG 的成立也设定了期限,要求于2017 年11 月26 日前完成。对于成员国主管机构之间的协调,设定期限为2018 年5 月26 日。

第三,科学的理念体现在法规的细节规定或管理要求中。如器械产品种类繁多,法规对于类别产品,其符合性评估程序中分别规定了要求,例如与一同使用的器械的认程序、利用人类或动物源组织或及其物制造器械时的认程序等,体现产品的个性化要求;对于高风险产品,欧盟法规规定了小组的职责中包含前咨询的程序;对于变更事项的规定,欧盟法规更接近产品本身,如涉及设计或特性的更改、协调标准更改等,使得变更事项更为明确。
欧盟法规已经升级了,您的产品属于I类吗?欧盟新法规要求非常严苛,您是否按照新法规MDR/IVDR办理了CE了?是否有欧盟代表,欧盟注册,SRN号码,Basic UDI,是否已经申报数据库Eudamed?
http://sungofda.cn.b2b168.com