周期4周
国家瑞士
有效期1年
费用来电面议
认项目瑞士代表
如果制造商不在欧盟或欧洲经济区内,同时又没有在2021年5月26日之前欧盟授权代表的制造商,应在2021年5月26日或者进行瑞士器械贸易时瑞士代表。
近因为瑞士推出了新规,MedDO,基于MDR法规要求对器械的定义、上市要求、产品分类,经济运营商的义务及器械方式等做出了详细规定。
器械出口瑞士市场服务方案
如果您是生产器械的企业,希望进军瑞士市场。我们能为您提供如下的服务方案:
1、协助判定产品分类
2、瑞士MedDO法规技术文件编写
3、瑞士授权代表服务
4、瑞士注册
欧盟法规已经升级了,您的产品属于I类吗?欧盟新法规要求非常严苛,您是否按照新法规MDR/IVDR办理了CE了?是否有欧盟代表,欧盟注册,SRN号码,Basic UDI,是否已经申报数据库Eudamed?
2:英国已经脱欧了,不再认可欧洲的CE书,需要UKCA认,有英代,MHRA注册,才可以合规出口英国。
3:瑞士也已经不认可欧洲的CE认,您有产品出口瑞士吗?是否有做瑞士代表以及瑞士注册的?
4:手术衣510K,隔离衣510K,手套510K,电动/手动轮椅510K,FDA注册,FDA美国代理人
5:ISO13485认,CE评估报告编写,FDAQSR820等产品出口的相关认

PART2 什么时候需要瑞士代表?
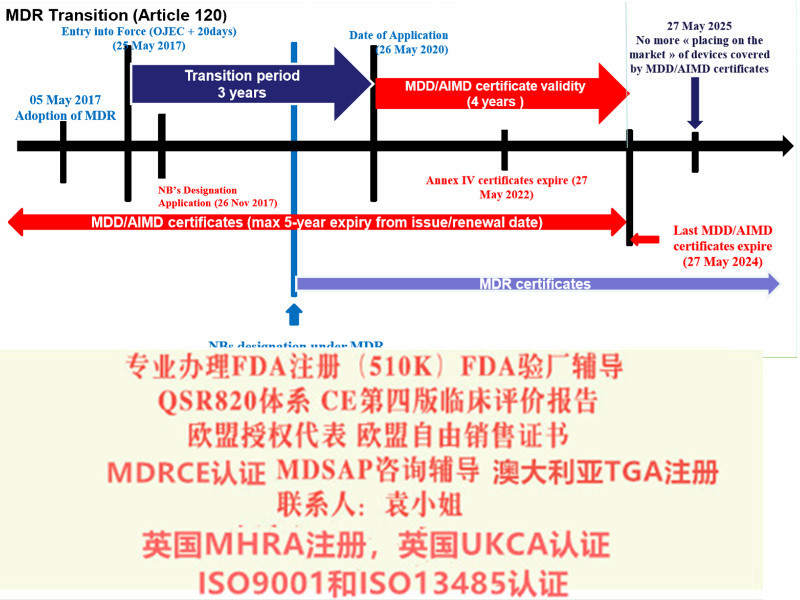
2.1 制造商在欧盟/欧洲经济区内或者了欧盟授权代表
此时制造商享有过渡期,在过渡期截止日期之前瑞士代表即可。
对于III类器械、IIb类植入式器械和有源植入式器械:2021年12月31日
对于非植入式IIb类设备和IIa类设备:2022年3月31日
对于I类设备:截至2022年7月31日
对于系统和程序包必须在2022年7月31日**名符合第51条第5款的授权代表。
2.2 如果制造商不在欧盟或欧洲经济区内,同时又没有在2021年5月26日之前欧盟授权代表的制造商,应在2021年5月26日或者进行瑞士器械贸易时瑞士代表。

协助判定产品分类
1) I类器械:通常是指不接触人体或只接触完整皮肤的器械。
2) I-m(测量)器械:带有测量功能的I类器械。
3) I-s()器械:终以形式出现在市场上的I类器械。
4) IIa类器械:风险等级较一类器械高,一般是指暂时使用的侵入器械等,有能量交换或测量的有源器械。
5) IIb类器械:风险等级较高,一般指会对人体有潜在风险或者是长时间使用。
6) III类器械:风险等级,一般用于人体循环系统或大脑。
补充:瑞士立后,目前的法规在器械上更趋近于欧盟的MDR法规,而在体外诊断器械上的要求更趋近于IVDD法规的要求。。
享受一对一咨询
热门视频推荐
SUNGO创建于2006年。以助力大健康产品**流通为使命,我们致力于成为受用户信赖的合规服务机构。SUNGO的客户覆盖**洲,遍布30多个和地区,客户总数**过5000家。中国器械企业**过30%选择SUNGO,同时也有多家**器械企业选择SUNGO提供服务。
http://sungofda.cn.b2b168.com









