湖北MDRCE认型号
更新时间:2025-04-23 浏览数:35
所属行业:
商务服务 认服务
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
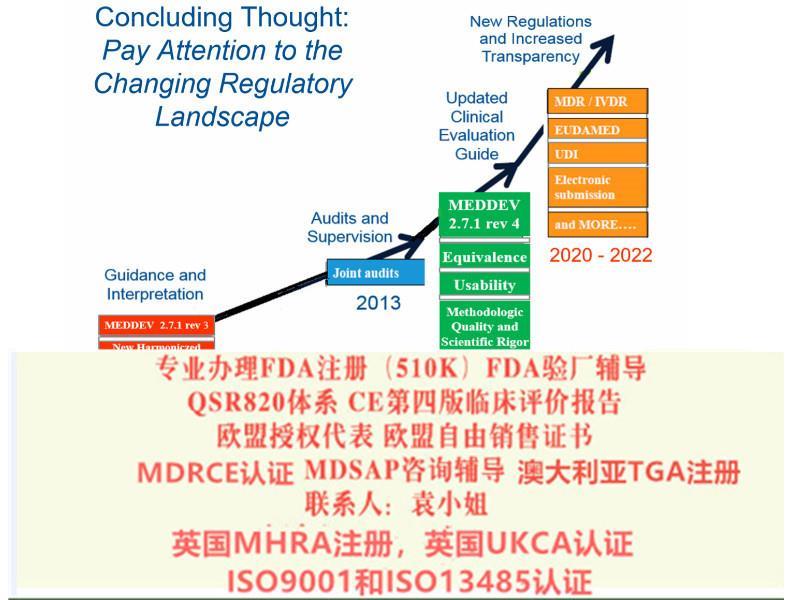
法规条款增加,认评审更加严格,基本要求检查表条目增加:由MDD的13条增加到 MDR的23条;
公司从2017年年初开展评估业务以来,为国内近两百家器械企业提供了评估报告编撰服务,其中包括很多国内的大型器械企业。第四版欧盟评估指南的发布,的确给企业带来了不小的挑战,此文对主要变化进行了梳理。

近两年,欧盟加强了评价和上市后监督的要求。2016年7月,器械评估的全新文件MEDDEV 2.7/1第4版在欧盟会网站上正式发布。该指南明确了现有的一些要求,对于制造商如何进行一个健全、系统的评价,以及如何数据和结论的科学有效性有了更明确的。这也给制造商带来了新的挑战。
制造商是否需要一个EAR
为符合上述欧盟设立EAR的要求,中国制造商如果在欧盟成员国或欧盟经济区或双边协议国境内没有商业注册地址,且从事制造出口体外诊断设备、器械、有缘可植入器械等CE指令中要求的产品时,则需要相应法律实体或自然人作为自己的欧洲授权代表。
EAR应帮助制造商履行哪些职责

MDR简介
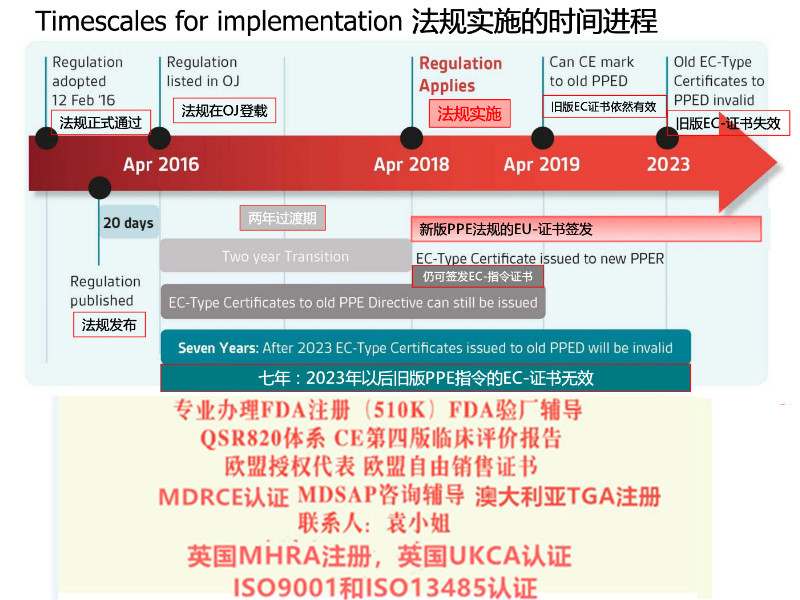
2017年5月5日,欧盟(Official Journal of the European Union)正式发布了欧盟器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类器械指令)and 93/42/EEC(器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE书并保持书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效。
2021年MDR法规的实施日期逐渐临近,如何在过渡期截至前取得MDD的,如何或快速取得MDR。上海沙格有着的咨询师团队,丰富的案例经验。
http://sungofda.cn.b2b168.com