产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
级医用防护服、隔离衣、手术衣, 选择具有MDR审核的公告机构,提交认申请,签订认合同;
管理条例规定的职责和具体内容
1)代表制造商;
2)应要求向主管当局提供制造商授权委托其为EAR的副本;
3)验制造商起草的欧盟符合性声明和技术文件;
4)在适用的情况下,验制造商是否已执行适当的合格评定程序;
5)保留一份技术文件、符合性声明的副本,如果适用,还应保留一份相关书的副本,供主管当局使用;
6)遵守注册义务;
7)验制造商设备注册所需承担义务的符合性;
8)应要求向主管当局提供必要的信息和文件,以设备的一致性;
9)向制造商发送主管当局对样品或设备访问的任何请求,并验主管当局是否收到样品或获得设备访问权限;
10)与主管当局合作,采取任何预防或纠正措施,以或减轻设备造成的风险;
11)向制造商通报人员、患者和用户对其设备相关疑似事件的投诉和报告;
12)应在与制造商相同的基础上对有缺陷的设备承担法律责任,并与制造商承担连带责任。
[img/new19/sungo99/1565589799.jpg[/img]
(三)如何选择EAR
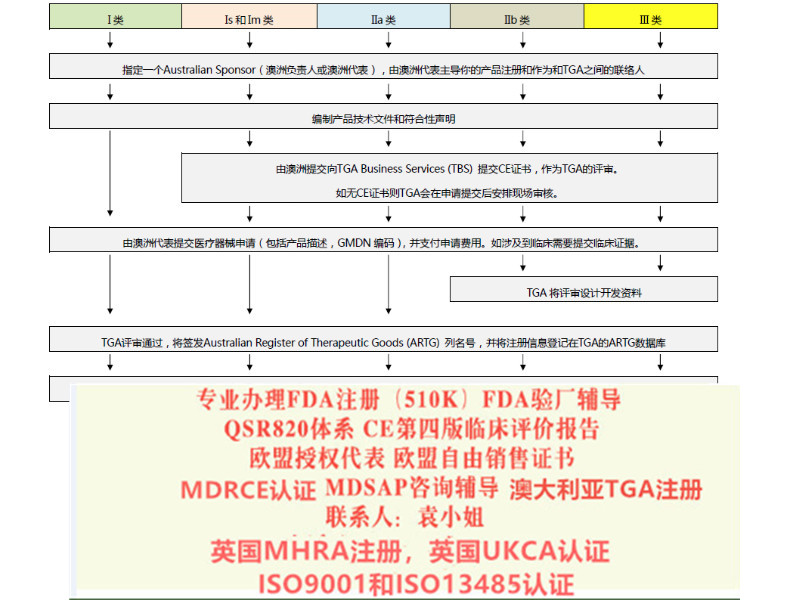
01医用防护服、隔离衣、手术衣
产品在进入欧盟市场前,企业需根据产品的预期用途,结合欧盟器械法规(EU)2017/745中附录Ⅷ要求,将产品分为I类、II类及III类,产品风险等级越高,分类等级越高,进入欧盟市场要求越高。
医用防护服、隔离衣、手术衣在MDR中属于Ⅰ类产品,风险等级相对较低,对于非级医用防护服、隔离衣、手术衣和级医用防护服、隔离衣、手术衣,产品走的认途径也不一样。
1.1 非级医用防护服、隔离衣、手术衣
非级医用防护服、隔离衣、手术衣在MDR中属于普通I类产品,不需要公告机构介入,企业只需通过自我符合性声明的途径进行产品注册,但注册前要完成以下工作:
① 按照MDR附录II+附录III的要求编制CE技术文件;
② 欧盟授权代表;
③ 完成欧盟主管当局注册,注册通常需要4-6周。

出口非欧盟为:
国外的客户,想要进口中国工厂的产品,需要客户,先要把产品在当地的局进行注册,完成注册后,才可以进口,销售。

MDR的主要变化:
1.扩大申请范围
2.提出的新概念和设备定义
3.优化器械的分类
4.提高设备的一般性和性能要求
5.加强对技术文件的要求
6.设备上市后加强监督
7.提高评估的相关要求
8.建议建立和使用Eudamed数据库
9.提出设备可追溯性(UDI)
10. NB的严格要求
英国已经脱欧了,不再认可欧洲的CE书,需要UKCA认,有英代,MHRA注册,才可以合规出口英国。
http://sungofda.cn.b2b168.com









