产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
关于欧盟CE 认的MDR 2017/745法规升级:
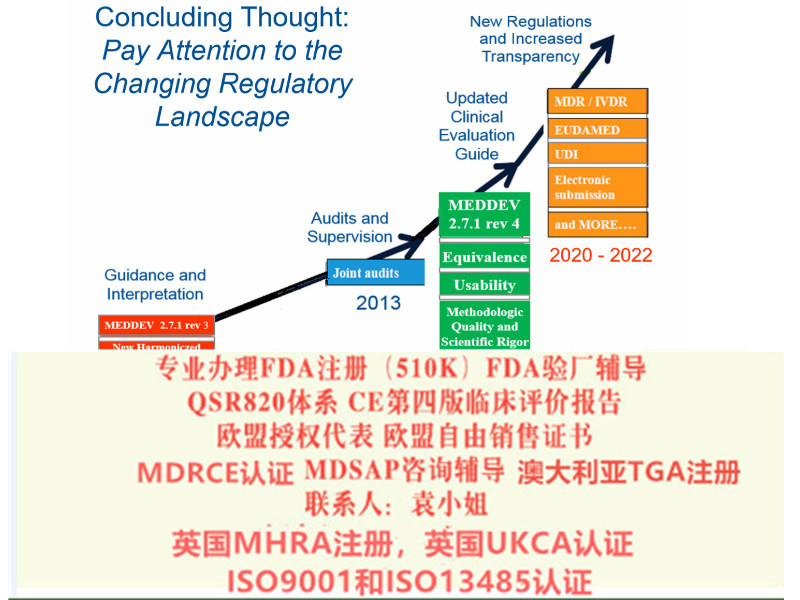
从2020年5月开始公告机构不能按照MDD颁发CE,目前I*及以上风险等级产品认机构已不再受理MDD指令的认申请。
对于目前获得CE的企业,应基于自身设备的据的充分性合理安排申请MDR的时间,尽快启动MDR法规合规准备事宜。
主要变化之七:比对器械的数据获得
第四版评估指南要求公告机构对于企业是否能够获得比对器械的数据进行挑战,这个被认为是法规的一个转折点,这要求制造商需要有一个被允许接触竞争对手的器械数据的协议。
主要变化之八:什么时候需要试验
第四版评估指南附件2详细描述了器械的风险以及制造商怎么决定是否具备了充分的据。

2017年5月5日欧盟发布OfficialJournal在这里我司需要特别说明的是欧盟此次是直接发布的Regulation(法规)而相比较之前的Directive(指令)其区别在于:提高了文件的约束力,发布立即在欧盟成员国生效并成为有约束力的法律,此次的Regulation*向Directive那样需要经过成员国转化成当地法律法规去落实实施。器械法规(MDR)转换期为3年,2020年5月4日起强制实行。

对III类和可植入器械,提出了评估报告更新的频率;明确实质等同性需考虑的特点;要求其与风险管理的相互作用等等。申请MDR 技术文件需要资料 1.公司信息 2.产品信息 3.工艺流程 4. 5.其它技术文件申请MDR 技术文件周期: 正常4周左右,如有节假日顺延,如有紧急,可申请MDR法规
我司注意到新法规主要在以下几点上发生了变化:1.器械的定义;2.器械的分类;3.基本和性能要求;4.技术文件要求;5.评价;6.上市后;7.Eudamed数据库;8.对NB公告机构的要求(新法规生效后NB将按照新的要求重新进行授权);9.对高风险器械的新增了要求;MDR&IVDR修订要点15) 欧盟代表与进口商和制造商一起起到连带责任欧盟代表要求, 类似于法规负责人16) 平行贸 Parallel Trade, 特别是重新贴标签或重新包装17) 一次性器械的再加工和使用:- 符合成员国的法规要求- 再加工方要承担法定制造商的责任;- 由机构或外部加工方进行的一次性MD的再加工和再使用必须要符合通用技术规范或协调标准或成员国的法规要求.- 再加工器械的和性能应等同于初期的一次性MD18) 植入器械: 患者应获得基本的信息, 包括标识, 危害健康的警示或注意事项19) 带有CE标记的MD, 在欧盟内可以自由流通和销售. 但成员国可以限制某些器械的使用.20) 除了定制器械外, 所有器械都应应用UDI系统 (MDR执行后1-5年)21) EUDAMed, MD的 命名Code22) 植入和III类产品的制造商应公开产品的主要和性能, 及评估结果的概要.- 和性能的概要应特别包括该产品在与其他诊断或方法比较时的重要性,和二者的使用条件23) 在欧盟的层面上管理NB
我公司办理:出口欧盟的新MDR和IVDR的CE,欧盟授权代表,欧盟注册,BASCI UDI申报
http://sungofda.cn.b2b168.com









